죽음의 계곡으로 추락한 알츠하이머병 치료제 '아두카누맙'에 기사회생의 길이 생겼다.
최근 바이오젠과 에자이는 아두카누맙의 임상 3상 결과에 대한 추가 분석 결과, 1차 평가 변수를 만족했다는 발표를 한 데 따른 것이다.
회사 측은 이 자료를 바탕으로 FDA와 신약신청에 대한 논의를 진행했으며, 내년 아두카누맙에 대한 허가를 신청하겠다는 계획도 밝혔다.
이 같은 계획을 공개하자 새로운 신약에 대한 기대감과 함께 바이오젠의 주가는 우뚝 치솟았다.
하지만 회사가 공개한 자료만 가지고는 신약 승인에 대한 확신이 서지 않는다는 것이 연구자들의 평이다.
아두카누맙은 지난 3월 'EMERGE'와 'ENGAGE'로 명명된 임상 3상에 대한 무용성 평가 결과, 유의미한 결과를 도출하지 못해 임상 중단을 선언한 바 있다.
하지만 바이오젠은 3월 임상을 중단한 이후 9월까지 6개월 동안 250여명의 환자가 추가된 데이터를 분석한 결과, 유의미한 결과를 도출했다고 밝혔다.
임상을 성공했다고 평가하기 위해 가장 중요한 것은 1차 평가 지표의 만족 여부다.
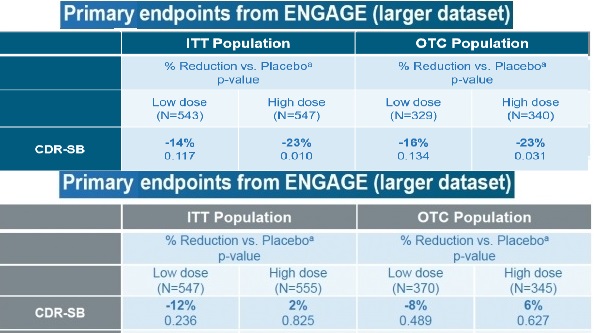
2개 임상의 1차 평가지표는 CDR-SB였으며, 2차 평가지표는 MMSE, ADAS-Cog13, ADCS-ADL-MCI 등이었다.
지난 3월 임상 중단을 발표했을 당시 아두카누맙은 1차 평가지표와 2차 평가지표에서 유의미한 결과를 찾지 못했다.
이번 발표에서는 EMERGE에 참여한 일부 환자들의 CDR-SB가 위약 투여군 대비 23% 감소했다는 결론을 도출했다.
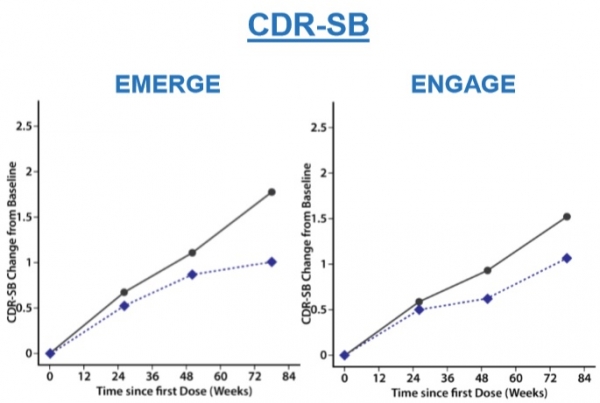
위약의 경우 약을 투여한 지 18개월 동안 CDR-SB 점수가 약 1.7점 증가한 반면, 아두카누맙 투여군은 약 1점 증가에 그쳤다.
하지만 이는 반쪽짜리 결과다. EMERGE에 참여한 환자 중 아두카누맙 고용량을 투여받은 환자에서만 도출된 결과이기 때문이다.
실제 같은 임상에서 저용량을 복용한 환자는 위약 대비 효과를 입증하지 못했으며, 다른 임상시험인 ENGAGE 역시 1차 평가지표를 만족시키지 못했다.
EMERGE와 ENGAGE는 서로 유사하게 설계된 임상이지만 한 쪽 임상의 일부에서만 유의미한 결과가 나왔다는 것도 부정적 요소일 수 있다.
임상 데이터에서 일부만 추출된 자료에 대한 분석은 전체 임상의 결론을 흐릴 수 있기 때문이다.
특히 바이오젠은 CDR-SB 점수 변화만 공개하고, 원점수는 아직 공개하지 않은 점도 석연치 않은 부분이다.
다만 바이오젠과 FDA가 교감 끝에 신약허가신청을 용인했다는 점은 긍정적인 요소로 작용할 것으로 보인다.
아두카누맙 고용량 투여를 전제로 한 조건부 허가 등을 허용할 가능성이 열렸다는 의미일 수도 있기 때문이다.
현재 바이오젠이 공개한 자료로는 임상 성공 여부를 판단하기에는 무리가 있는 만큼 추가적인 자료 공개가 있어야 할 것으로 보인다.


